Строение, классификация и функции рецептора сенсорных систем
Содержание:
- Что такое рецепторы?
- Секретные PRR
- Зрительная сенсорная система
- Потеря функции
- Функции рецепторов
- Сенсорное возбуждение
- Структура
- Вкусовая сенсорная система
- Виды рецепторов и их классификация
- Рецепторы человека[править | править код]
- Виды рецепторов[править | править код]
- Киназы nonRD
- Топические антигистаминные препараты
- Н1‑блокаторы II поколения
- Конститутивная активность рецептора
Что такое рецепторы?
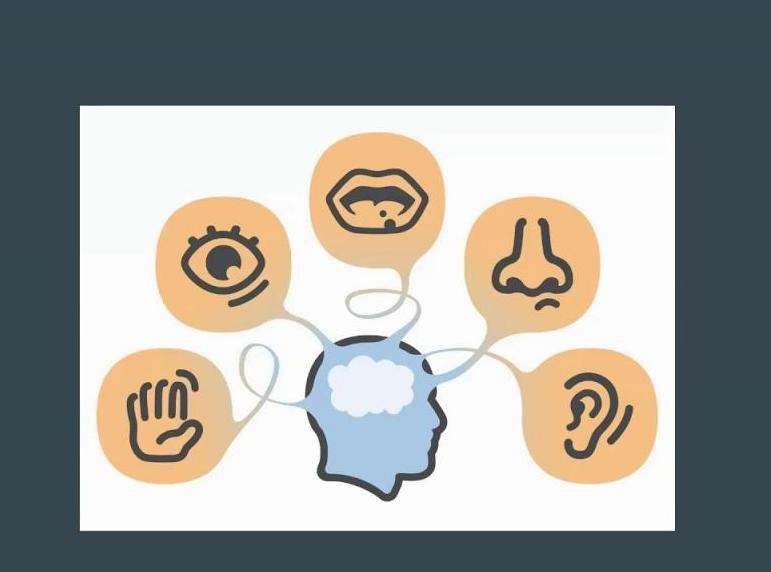
Сенсорные системы человека разделяются на следующие типы:
- зрительную;
- равновесия;
- вкусовую;
- слуховую;
- обонятельную;
- осязательную;
- проприоцептивную;
- висцеральную.
Принцип работы каждой системы одинаков. Функции рецептора отличаются в зависимости от системы и реагируют на определенный вид раздражителя. Некоторые сенсорные системы человек осознает частично. Например, висцеральная система обрабатывает информацию о химическом составе жидкостей тела.
Сенсорные системы находятся в постоянном взаимодействии, и при нарушении функций нервных рецепторов происходит частичная компенсация за счет других систем.
Сенсорная система состоит из периферического, проводникового и центрального отделов. Основу периферического отдела составляют рецепторы, которые находятся в органах чувств. Они принимают раздражители и преобразуют их в нервные импульсы. Рецепторы не чувствительны к слабым раздражителям и тем воздействиям, которые оказывают влияние на организм длительное время.
Проводниковый отдел отвечает за передачу информации по аксонам в центральную нервную систему. Импульсы попадают в таламус, а затем в кору головного мозга.
Центральный отдел располагается в коре больших полушарий головного мозга. В них информация анализируется и определяется необходимость ответной реакции.
Секретные PRR
Некоторые PRR не остаются связанными с клеткой, которая их производит. Рецепторы комплемента , коллектины , фиколины , пентраксины, такие как сывороточный амилоид и С-реактивный белок , липидные трансферазы , белки распознавания пептидогликана (PGRP) и LRR, XA21D, все являются секретируемыми белками. Одним из очень важных коллектинов является маннан-связывающий лектин (MBL), основной PRR врожденной иммунной системы, которая связывается с широким спектром бактерий, вирусов, грибов и простейших. MBL преимущественно распознает определенные группы сахаров на поверхности микроорганизмов, но также связывает фосфолипиды , нуклеиновые кислоты и негликозилированные белки. После связывания с лигандами олигомеры MBL и фиколина рекрутируют MASP1 и MASP2 и инициируют лектиновый путь активации комплемента, который в некоторой степени похож на классический путь комплемента .
Зрительная сенсорная система
Одна из наиболее значимых систем в жизни человека и имеющая сложное строение. Основными органами в зрительной системе являются глаза. Рассмотрим, что такое рецепторы глаз. Сетчатка глаза представляет собой центр нервных окончаний, в котором осуществляется обработка поступающих сигналов и преобразование их в импульсы, готовые для передачи в головной мозг. Сигналы передаются благодаря специальным клеткам с различными функциями:
- фоторецепторы (колбочки и палочки);
- ганглиозные клетки;
- биполярные клетки.
Благодаря светочувствительным клеткам зрительный анализатор осуществляет восприятие цветного изображения в дневное и сумеречное время суток со скоростью в 720 м/с.
Потеря функции
У многих видов вкусовые рецепторы утратили свои функции. Эволюционный процесс, в котором вкусовые рецепторы утратили свою функцию, считается адаптивной эволюцией, связанной с экологией кормления, определяющей специализацию и раздвоение вкусовых рецепторов. Показано, что из всех вкусовых рецепторов горький, сладкий и умами имеют корреляцию между инактивацией вкусовых рецепторов и пищевым поведением. Однако нет убедительных доказательств того, что у позвоночных отсутствуют гены рецепторов горького вкуса.
Рецептор сладкого вкуса является одним из вкусовых рецепторов, функция которого утрачена. У млекопитающих преобладающим рецептором сладкого вкуса является вкусовой рецептор типа 1 Tas1r2 / Tas1r3. Некоторые виды млекопитающих, такие как кошки и летучие мыши-вампиры, показали неспособность чувствовать сладкий вкус. У этих видов причина потери функции сладкого рецептора связана с псевдогенизацией Tas1r2. Псевдогенизация Tas1r2 также наблюдается у видов, не относящихся к млекопитающим, таких как куры и безъязычная западная когтистая лягушка, и эти виды также демонстрируют неспособность ощущать сладкий вкус. Псевдогенизация Tas1r2 широко распространена и независима в отряде Carnivora. Многие исследования показали, что псевдогенизация вкусовых рецепторов вызвана вредной мутацией в открытых рамках считывания (ORF). В ходе исследования было обнаружено, что у хищных видов, не относящихся к кошачьим, эти виды демонстрировали мутации Tas1r2, нарушающие ORF, и они возникали независимо среди видов. Они также показали большую вариативность в своих родословных. Предполагается, что псевдогенизация Tas1r2 произошла в результате конвергентной эволюции, когда плотоядные виды потеряли способность ощущать сладкий вкус из-за пищевого поведения.
Умами также является вкусовым рецептором, функция которого у многих видов утрачена. Преобладающими рецепторами вкуса умами являются Tas1r1 / Tas1r3. У двух линий водных млекопитающих, включая дельфинов и морских львов, было обнаружено, что Tas1r1 является псевдогенизированным. Псевдогенизация Tas1r1 также была обнаружена у наземных хищных видов. Хотя панда принадлежит к отряду Carnivora, она травоядна, где 99% ее рациона составляет бамбук, и она не может попробовать умами. Последовательность генома панды показывает, что ее ген Tas1r1 псевдогенизирован. В ходе исследования было обнаружено, что у всех видов отряда Carnivora, кроме панды, открытая рамка считывания сохранялась. Было обнаружено, что у панды соотношение несинонимичных и синонимичных замен намного выше, чем у других видов отряда Carnivora. Эти данные коррелируют с датой окаменелостей панды, чтобы показать, где она перешла с хищной диеты на травоядную. Таким образом, предполагается, что потеря функции умами у панды вызвана изменением диеты, когда панда стала меньше зависеть от мяса. Однако эти исследования не объясняют травоядных животных, таких как лошади и коровы, которые сохранили рецептор Tas1r1.
В целом, потеря функции вкусового рецептора — это эволюционный процесс, произошедший из-за изменения рациона видов.
Функции рецепторов
Работа сенсорной системы зависит от деятельности рецептора:
- Распознавание сигналов. Любая система умеет различать и приспосабливаться к внешним раздражителям. Глаза реагируют на свет или механическое воздействие. Влияние света будет восприниматься по-разному, в зависимости от степени освещения. При ярком луче солнца человек непроизвольно зажмурится. При попадании инородного предмета в глаз, возникнет боль.
- Определение разнообразия сигналов.
- Передача сигналов в кору головного мозга для дальнейшей обработки информации.
- Энергия раздражителя преобразовывается в энергию нервного раздражения. При кодировке сигнала не должно произойти искажения.
- Информация для передачи не меняется в пространстве. При воздействии нескольких раздражителей все системы работают независимо друг от друга, при этом взаимодействуют.
- При длительном воздействии раздражителей включаются тормозные элементы, которые приостанавливают соседние рецепторы
Для нормальной работы сенсорной системы рецепторы кодируют информацию в форме нервных импульсов, определяют раздражитель, выявляют образ, адаптируются к воздействию внешних раздражителей.
Сенсорное возбуждение
Строение и функции рецепторов оказывают влияние на восприятие информации от раздражителя. Первичные рецепторы получают информацию от чувствительного нейрона. Их мембрана заряжается энергией за счет изменения проницаемости солей натрия. Повышенная проницаемость к ионам натрия формирует рецепторный потенциал, и пока происходит раздражение, сигнал будет передаваться.
Потенциал рецептора зависит от силы раздражения. Чем сильнее воздействие, тем он сильнее. Если увеличивается количество раздражителей, то потенциал может суммироваться.
При воздействии на вторичный рецептор потенциал возникает в нервной клетке. Свойства схожи с рецепторным потенциалом, амплитуда зависит от выделения медиатора.
Потенциал может нарастать или исчезать. Рецепторы адаптируются к внешним раздражителям, часть быстро, остальные медленно. Привыкнув к раздражителю, амплитуда сигнала начинает угасать, и человек перестает воспринимать раздражитель. Таким образом происходит привыкание к запаху, частичное — к громким звукам и вкусовым ощущениям.
Информация кодируется по различным критериям: частоте потенциала, времени импульса, количеству задействованных рецепторов.
Структура
Структуры рецепторов очень разнообразны, и в целом их можно разделить на следующие категории:
Тип 1: L (ионотропные рецепторы)
Эти рецепторы обычно являются мишенями для быстрых нейротрансмиттеров, таких как ацетилхолин (никотин) и ГАМК. Активация этих рецепторов приводит к изменениям в движении ионов через мембрану. Эти рецепторы имеют гетеро-структуру. Каждая субъединица состоит из внеклеточного лиганд-связывающего домена и трансмембранного домена, а трансмембранный домен, в свою очередь, включает в себя четыре трансмембранных альфа-спиралей. Полости связывания лиганда расположены на границе раздела между субъединицами.
Тип 2: G-протеин-связанные (метаботропные) рецепторы
Это наиболее многочисленное семейство рецепторов, включающее в себя рецепторы для ряда гормонов и медленных передатчиков, например, дофамин, метаботропный глутамат. Эти рецепторы состоят из семи трансмембранных альфа-спиралей. Петли, соединяющие альфа спирали, образуют внеклеточные и внутриклеточные домены. Участки связывания больших пептидных лигандов, как правило, находится во внеклеточном домене, тогда как участки связывания небольших непептидных лигандов часто расположены между семью альфа-спиралями и одной внеклеточной петлей. Эти рецепторы соединены с различными внутриклеточными эффекторными системами с помощью G-белков.
Тип 3: рецепторы, связанные и родственные с киназой
Эти рецепторы состоят из внеклеточного домена, содержащего лиганд-связывающий участок и внутриклеточный домен, часто с ферментативной функцией, и связаны с одной трансмембранной альфа-спиралью, например, рецептор инсулина.
Тип 4: ядерные рецепторы
Несмотря на свое название, ядерные рецепторы в действительности находится в цитозоле и мигрируют в ядро после связывания с их лигандами. Они состоят из С-концевого лиганд-связывающего участка, ядерного ДНК-связывающего домена и N-концевого домена, который содержит участок AF1 (функции активации 1). Участок ядра имеет два цинковых отростка, отвечающих за распознавание последовательностей ДНК, специфичных для данного рецептора. N-терминал взаимодействует с другими факторами клеточной транскрипции лиганд-независимым образом и, в зависимости от этих взаимодействий, может изменять связывание / активность рецептора. Примерами таких рецепторов являются стероидные рецепторы и рецепторы гормонов щитовидной железы.
Мембранные рецепторы могут быть выделены из клеточных мембран в результате сложных процедур извлечения с использованием растворителей, детергентов и / или методов аффинной очистки.
Структура и активность рецепторов могут быть изучены с помощью биофизических методов, таких как рентгеновская кристаллография, ЯМР, круговой дихроизм и двойная поляризационная интерферометрия. Методы компьютерного моделирования динамического поведения рецепторов используются для лучшего понимания механизма их действия.
Вкусовая сенсорная система
Основным органом в этой системе является язык, благодаря рецепторам которого человеческий мозг способен оценить качество и вкус употребляемой пищи и напитков.
На языке располагаются механорецепторы, способные оценить консистенцию продуктов, терморецепторы, определяющие уровень температуры пищи и хеморецепторы, непосредственно занимающиеся определением вкуса. Рецепторы языка располагаются во вкусовых сосочках (почках), содержащих в себе набор белков, которые при контакте с раздражителем меняют свои химические свойства, тем самым образуя нервный импульс для передачи в мозг. Они способны различать четыре типа вкусов:
- соленый — передняя часть языка (кроме кончика);
- горький — задняя часть органа;
- кислый — боковые рецепторы;
- сладкий — рецепторы кончика языка.
Но только в совокупности с обонятельной системой человеческий мозг способен оценить полноту передаваемых рецепторами ощущений и, в случае чего, уберечь от непригодных к употреблению продуктов.
Виды рецепторов и их классификация
Для каждого ощущения, научно называемого раздражителем, существует свой вид анализатора, который способен преобразовать его в доступный для нервной системы импульс. Чтобы лучше понимать, что такое рецепторы, сначала нужно разобраться в их классификации.
Рецепторы могут различаться по месту локализации и типу принимаемых сигналов:
- экстерорецепторы — это вкусовые, зрительные, слуховые и осязательные рецепторы;
- интерорецепторы — отвечающие за опорно-двигательный аппарат и контроль внутренних органов.
Еще рецепторы человека классифицируются в зависимости от формы проявления раздражителя:
- хеморецепторы — рецепторы обоняния, языка и сосудов;
- механорецепторы- вестибулярные, тактильные, слуховые;
- терморецепторы- кожные и рецепторы внутренних органов;
- фоторецепторы — зрительные;
- ноцицептивные (болевые) рецепторы.
Рецепторы также различают по способности к количественной передаче импульсов:
- мономодальные — способны передавать лишь один вид раздражителя (слуховые, зрительные);
- полимодальные — могут воспринимать несколько видов (болевые рецепторы).
Рецепторы человека[править | править код]
Рецепторы кожиправить | править код
- Свободные нервные окончания — нервные окончания, состоящие только из конечных ветвлений осевого цилиндра. Располагаются в эпителии. Выступают в качестве терморецепторов, механорецепторов и ноцицепторов (то есть отвечают за восприятие изменения температуры, механических воздействий и болевые ощущения).
- Несвободные нервные окончания:
- Тельца Пачини — инкапсулированные рецепторы давления в округлой многослойной капсуле. Располагаются в подкожно-жировой клетчатке. Являются быстроадаптирующимися (реагируют только в момент начала воздействия), то есть регистрируют силу давления. Обладают большими рецептивными полями, а потому обладают грубой чувствительностью.
- Тельца Мейснера — инкапсулированные рецепторы давления, расположенные в дерме. Представляют собой слоистую структуру с нервным окончанием, проходящим между слоями. Являются быстроадаптирующимися. Обладают малыми рецептивными полями, а потому обладают тонкой чувствительностью.
- Тельца Меркеля — некапсулированные рецепторы давления. Располагаются у птиц — в дерме, у прочих позвоночных — в глубоких слоях эпидермиса. Являются медленноадаптирующимися (реагируют на всей продолжительности воздействия), то есть регистрируют продолжительность давления. Обладают малыми рецептивными полями.
- Тельца Руффини — инкапсулированные рецепторы растяжения. Являются медленноадаптирующимися, обладают большими рецептивными полями. Реагируют также на тепло.
- Колбы Краузе — инкапсулированные рецепторы, расположенные в надсосочковом слое дермы. Раньше считалось, что у колб Краузе есть специфическая чувствительность, но их роль в качестве холодовых рецепторов не подтвердилась. .
- Рецепторы волосяных фолликулов — механорецепторы, расположенные в волосяных фолликулах и реагирующие на отклонение волоса от исходного положения.
Рецепторы мышц и сухожилий (проприоцепторы)править | править код
-
Мышечные веретена — рецепторы растяжения мышц, бывают двух типов:
- с ядерной сумкой
- с ядерной цепочкой
- Сухожильный орган Гольджи — рецепторы сокращения мышц. При сокращении мышцы сухожилие растягивается и его волокна пережимают рецепторное окончание, активируя его.
Рецепторы связокправить | править код
В основном представляют собой свободные нервные окончания (Типы 1, 3 и 4), меньшая группа — инкапсулированные (Тип 2). Тип 1 аналогичен окончаниям Руффини, Тип 2 — тельцам Паччини.
Рецепторы сетчатки глазаправить | править код
Сетчатка содержит палочковые и колбочковые фоточувствительные клетки, в которых имеются светочувствительные пигменты. Палочки чувствительны к очень слабому свету, это длинные и тонкие клетки, сориентированные по оси прохождения света. Все палочки содержат один и тот же светочувствительный пигмент. Колбочки требуют намного более яркого освещения, это короткие конусообразные клетки, у человека колбочки делятся на три вида, каждый из которых содержит свой светочувствительный пигмент — это и есть основа .
Под воздействием света в рецепторах происходит выцветание — молекула зрительного пигмента поглощает фотон и превращается в другое соединение, хуже поглощающее свет на этой длине волны. Практически у всех животных (от насекомых до человека) этот пигмент состоит из белка, к которому присоединена небольшая молекула, близкая по структуре к витамину A. Эта молекула и представляет собой химически трансформируемую светом часть. Белковая часть выцветшей молекулы зрительного пигмента активирует молекулы трансдуцина, каждая из которых деактивирует сотни молекул циклического гуанозинмонофосфата, участвующих в открытии пор мембраны для ионов натрия, в результате чего поток ионов прекращается — мембрана гиперполяризуется.
Чувствительность палочек такова, что адаптировавшийся к полной темноте человек способен увидеть вспышку света такую слабую, что каждый рецептор получит не больше одного фотона. При этом палочки не способны реагировать на изменения освещённости, когда свет настолько ярок, что все натриевые каналы уже закрыты.
Виды рецепторов[править | править код]
Существует несколько классификаций рецепторов:
- По положению в организме
- Экстерорецепторы (экстероцепторы) — расположены на поверхности или вблизи поверхности тела и воспринимают внешние стимулы (сигналы из окружающей среды)
- Интерорецепторы (интероцепторы) — расположены во внутренних органах и воспринимают внутренние стимулы (например, информацию о состоянии внутренней среды организма)
- По способности воспринимать разные стимулы
- Мономодальные — реагирующие только на один тип раздражителей (например, фоторецепторы — на свет)
- Полимодальные — реагирующие на несколько типов раздражителей (например, многие болевые рецепторы, а также некоторые рецепторы беспозвоночных, реагирующие одновременно на механические и химические стимулы)
- По адекватному раздражителю:
- Хеморецепторы — воспринимают воздействие растворённых или летучих химических веществ
- Осморецепторы — воспринимают изменения осмотической концентрации жидкости (как правило, внутренней среды)
- Механорецепторы — воспринимают механические стимулы (прикосновение, давление, растяжение, колебания воды или воздуха и т. п.)
- Фоторецепторы — воспринимают видимый и ультрафиолетовый свет
- Терморецепторы — воспринимают понижение (холодовые) или повышение (тепловые) температуры (тепловые стимулы)
- Болевые рецепторы, стимуляция которых приводит к возникновению болевых ощущений. Такого физического стимула, как боль, не существует, поэтому выделение их в отдельную группу по природе раздражителя в некоторой степени условно. В действительности они представляют собой высокопороговые сенсоры различных (химических, термических или механических) повреждающих факторов. Однако уникальная особенность ноцицепторов, которая не позволяет отнести их, например, к «высокопороговым терморецепторам», состоит в том, что многие из них полимодальны: одно и то же нервное окончание способно возбуждаться в ответ на несколько различных повреждающих стимулов.
- Электрорецепторы — воспринимают изменения электрического поля
- Магнитные рецепторы — воспринимают изменения магнитного поля
У человека имеются первые шесть типов рецепторов. На хеморецепции основаны вкус и обоняние, на механорецепции — осязание, слух и равновесие, а также ощущения положения тела в пространстве, на фоторецепции — зрение. Терморецепторы есть в коже и некоторых внутренних органах. Большая часть интерорецепторов запускает непроизвольные и в большинстве случаев неосознаваемые, вегетативные рефлексы. Так, осморецепторы включены в регуляцию деятельности почек, хеморецепторы, воспринимающие pH, концентрации углекислого газа и кислорода в крови, включены в регуляцию дыхания и т. д.
Иногда предлагается выделять группу электромагнитных рецепторов, в которую включают фото-, электро- и магниторецепторы. Магниторецепторы точно не идентифицированы ни у одной группы животных, хотя предположительно ими служат некоторые клетки сетчатки птиц, а возможно, и ряд других клеток.
В таблице приведены данные о некоторых типах рецепторов
| Природа раздражителя | Тип рецептора | Место расположения и комментарии |
|---|---|---|
| • электрическое поле | • ампула Лоренцини и другие типы | • Имеются у рыб, круглоротых, амфибий, а также у утконоса и ехидны |
| • химическое соединение | • хеморецептор | |
| • влажность | • гигрорецептор | • Относятся к осморецепторам или механорецепторам. Располагаются на антеннах и ротовых органах многих насекомых |
| • механическое воздействие | • механорецептор | • У человека имеются в коже (экстероцепторы) и внутренних органах (барорецепторы, проприоцепторы) |
| • давление | • барорецептор | • Относятся к механорецепторам |
| • положение тела | • проприоцептор | • Относятся к механорецепторам. У человека это нервно-мышечные веретена, сухожильные органы Гольджи и др. |
| • осмотическое давление | • осморецептор | • В основном интерорецепторы; у человека имеются в гипоталамусе, а также, вероятно, в почках, стенках желудочно-кишечного тракта, возможно, в печени. Существуют данные о широком распространении осморецепторов во всех тканях организма |
| • свет | • фоторецептор | |
| • температура | • терморецептор | • Реагируют на изменение температуры. У человека имеются в коже и в гипоталамусе |
| • повреждение тканей | • ноцицептор | • В большинстве тканей с разной частотой. Болевые рецепторы — свободные нервные окончания немиелинизированных волокон типа C или слабо миелинизированных волокон типа Aδ. |
| • магнитное поле | • магнитные рецепторы | • Точное расположение и строение неизвестны, наличие у многих групп животных доказано поведенческими экспериментами |
Киназы nonRD
PRR обычно ассоциируются или содержат членов монофилетической группы киназ, называемой семейством киназ, ассоциированных с рецептором интерлейкина-1 (IRAK), которая включает Drosophila Pelle, человеческие IRAK, рисовый XA21 и Arabidopsis FLS2. У млекопитающих PRR могут также ассоциироваться с членами семейства киназ, взаимодействующих с рецепторами (RIP), дальними родственниками семейства IRAK. Некоторые киназы семейств IRAK и RIP попадают в небольшой функциональный класс киназ, называемых не-RD, многие из которых не аутофосфорилируют петлю активации. Исследование киномов дрожжей, мух, червей, человека, арабидопсиса и риса (3723 киназы) показало, что, несмотря на небольшое количество киназ, не относящихся к RD, в этих геномах (9–29%), 12 из 15 известных или прогнозируемых киназ для работы в сигнализации PRR попадают в класс не-RD. У растений все охарактеризованные PRR относятся к классу не-RD. Эти данные показывают, что киназы, ассоциированные с PRR, можно в значительной степени предсказать по отсутствию единственного консервативного остатка и выявить новые потенциальные подсемейства PRR растений.
Топические антигистаминные препараты
Местные Н1‑блокаторы позволяют обеспечить достижение достаточно высоких локальных концентраций препарата при низкой дозе и быстрое начало терапевтического эффекта — как правило, уже через 15 минут после введения. При этом количество побочных эффектов значимо уменьшается за счёт снижения системной концентрации препаратов.
Сегодня зарегистрирован ряд топических препаратов, в частности, антигистаминный препарат I поколения дифенгидрамин (применяется наружно) и представители II поколения Н1‑блокаторов левокабастин, азеластин и антазолин в комбинации с нафазолином (выпускаются в форме назального спрея и глазных капель).
По выраженности антигистаминного эффекта назальный спрей сравним с эффектом пероральных Н1‑блокаторов. Биодоступность при интраназальном введении выше, чем при использовании в форме глазных капель, что, скорее всего, связано с большей поверхностью всасывания и частичным проглатыванием препарата при орошении слизистой оболочки носа.
Левокабастин и азеластин можно рекомендовать посетителям с лёгким течением аллергического ринита и конъюнктивита, а при регулярном применении — для профилактики сезонной формы заболевания.
Источники
- Федоскова Т. Г. Антигистаминные препараты: мифы и реальность //Эффективная фармакотерапия, 2014. № 5. С. 28–34.
- Вдовиченко В. П. и др. Проблема выбора Н1‑блокатора в клинической практике //Медицинские новости, 2012. № 3.
- РААКИ. Федеральные клинические рекомендации по диагностике и лечению аллергического ринита. Москва, 2018. — 23 с.
- Кондюрина Е. Г. и др. Антигистаминные препараты первого поколения в педиатрической практике //РМЖ, 2011. Т. 19. № 22. С. 1357–1360.
- Клиническая фармакология и фармакотерапия: учебник. — 3‑е изд., доп. и перераб. / под ред. В. Г. Кукеса, А. К. Стародубцева. — М.: ГЭОТАР-Медиа, 2012. — 832 с.
- Ревякина В. А. Антигистаминные препараты в клинической практике //Русский медицинский журнал. Медицинское обозрение, 2014. Т. 22. № 11. С. 854–856.
- Карева Е. Н. Выбор антигистаминного препарата: взгляд фармаколога //РМЖ, 2016. Т. 24. № 12. С. 811–816.
- Борисова Е. О. Антигистаминные препараты: вопросы безопасности //Лечебное дело, 2005. № 2.
Н1‑блокаторы II поколения
Антигистаминные препараты II поколения были разработаны для устранения недостатков их предшественников. В отличие от последних, современные Н1‑блокаторы связываются и диссоциируют с Н1‑рецепторами медленно. Благодаря продолжительной связи с гистаминовыми рецепторами они способны обеспечивать длительный эффект, позволяющий применять их 1–2 раза в сутки. Доказано, что при регулярном приёме всех препаратов II поколения на протяжении месяца их терапевтический ответ не снижается, то есть тахифилаксия не развивается.
Показания
Неседативные антигистаминные препараты являются препаратами первой линии для лечения лёгких и умеренных форм аллергического ринита. Их уместно рекомендовать клиентам с незначительными симптомами аллергических заболеваний, а также аллергией средней тяжести.
Преимущества
Будучи сопоставимыми с первыми Н1‑блокаторами по антиаллергической активности, представители II поколения не проявляют седативный эффект и многие другие неблагоприятные реакции, что связано с их высокой селективностью и значительно меньшей способностью проникать через гематоэнцефалический барьер.
К преимуществам следует отнести длительное действие, возможность однократного применения в сутки, а также отсутствие тахифилаксии.
Переносимость
Несмотря на очевидные преимущества, некоторые препараты II поколения обладают редким, но серьёзным побочным эффектом, — способность вызывать нарушения сердечного ритма в виде удлинения интервала QT, развития желудочковой аритмии (типа «пируэт»), атриовентрикулярной блокады и блокады ножек пучка Гиса. Подобные аритмии проявляются эпизодами головокружения, обмороками, однако нередко могут протекать бессимптомно.
Кардиотоксический эффект носит дозозависимый характер. При применении препаратов в терапевтических дозах аритмогенные свойства практически не проявляются. Это связано с тем, что большинство антигистаминных II поколения представляют собой пролекарства, которые почти не определяются в кровотоке из‑за быстрой биотрансформации с образованием активных и длительно действующих метаболитов. Следует отметить, что биотрансформация антигистаминных препаратов II поколения происходит с помощью изофермента системы цитохрома Р450, активность которого могут угнетать некоторые препараты, в частности, кетоконазол, итраконазол, флуоксетин, флавоноид, содержащийся в соке грейпфрута и ряд других.
При передозировке, повышении концентрации пролекарства в крови, а также состояниях, при которых снижается скорость биотрансформации препарата (например, циррозе печени, одновременном назначении с препаратами, угнетающими активность изофермента системы цитохрома Р450), выраженность кардиотоксического эффекта Н1‑блокаторов II поколения увеличивается. Дополнительными факторами риска служат уже существующий синдром удлинённого интервала QT, одновременный приём препаратов с аритмогенной активностью, электролитные нарушения.
В то же время при правильном применении, соблюдении режима дозирования и противопоказаний антигистаминные II поколения хорошо переносятся и могут считаться безопасными для лечения аллергических заболеваний.
Аритмогенных свойств лишены лоратадин — как сам препарат, так и его активный метаболит, — а также дезлоратадин и фексофенадин. Кстати, последние не метаболизируются с участием изофермента системы цитохрома Р450 и не вступают в лекарственные взаимодействия с препаратами, угнетающими его активность.
О чём предупредить клиента?
Отпуская препараты этой подгруппы, важно напомнить о необходимости соблюдения режима дозирования во избежание развития побочных эффектов, в частности, кардиотоксического действия.
Кроме того, уместно обратить внимание клиента на то, что антигистаминные II поколения не следует принимать одновременно с препаратами, которые конкурируют с ними за печёночный метаболизм (кетоконазол, итраконазол, ранитидин, флуоксетин и другие).
Конститутивная активность рецептора
Рецептор, который способен осуществлять свою биологическую реакцию в отсутствие связанного лиганда, демонстрирует так называемую «конститутивную активность». Конститутивная активность рецептора можно заблокировать с помощью обратного агониста. Препараты против ожирения Rimonabant и Tarannabant являются обратными агонистами каннабиноидного рецептора CB1 и, несмотря на то, что оба препарата эффективно снижали вес, они были изъяты с рынка, в связи с высоким уровнем заболеваемости депрессией и тревогой, которые, предположительно, были связаны с торможением конституитивной активности каннабиноидных рецепторов.
Мутации в рецепторах, приводящие к увеличению конституитивной активности, лежат в основе некоторых наследственных заболеваний, таких как преждевременное половое созревание (в связи с мутациями рецепторов лютеинизирующего гормона) и гипертиреоз (в связи с мутациями рецепторов тиреотропного гормона).
