Гликолиз в мышечных волокнах
Содержание:
- В сочетании с сульфатредукцией
- Эффект Пастера
- Степень аэробности среды
- История изучения[править | править код]
- Бескислородный этап энергетического обмена
- Методы анаэробной очистки сточных вод
- В сочетании с сульфатредукцией
- Что такое гликолиз
- В сочетании с восстановлением нитратов и нитритов
- В сочетании с восстановлением нитратов и нитритов
- Гликолиз
- Анаэробное окисление: брожение и гниение
- Примечания[править | править код]
- В сочетании с сульфатредукцией
- Классификация анаэробов
В сочетании с сульфатредукцией
Три механизма анаэробного окисления метана (АОМ). Первый метод (вверху) осуществляется консорциумом анаэробных метанотрофных (ANME) архей из клад 1,2a, 2b и 2c и сульфатредуцирующих бактерий (SRB). Окисление метана происходит в ANME, где электроны передаются непосредственно в SRB, который выполняет восстановление сульфата. Второй метод (в центре) связывает окисление метана с восстановлением нитратов, опосредованным консорциумом архей ANME и бактерий Anammox. Третий механизм (внизу) также связывает окисление метана с восстановлением нитратов, но его опосредуют археи ANME и бактерии NC10. В отличие от первых двух механизмов, и археи ANME, и бактерии NC10 конкурируют за метан.
Общая реакция такова:
- CH 4 + SO 4 2− → HCO 3 — + HS — + H 2 O
Сульфат-управляемый АОМ опосредуется синтрофным консорциумом метанотрофных архей и сульфатредуцирующих бактерий . Часто они образуют небольшие агрегаты, а иногда и объемные маты. Партнер архей сокращенно АНМЕ, что означает «анаэробный метанотроф ». ANME очень тесно связаны с метаногенными археями, и недавние исследования показывают, что AOM является ферментативным обращением метаногенеза . До сих пор плохо изучено, как взаимодействуют синтрофические партнеры и какие промежуточные продукты обмениваются между архейной и бактериальной клеткой. Исследованию АОМ препятствует тот факт, что ответственные организмы не были изолированы. Это потому, что эти организмы демонстрируют очень медленные темпы роста с минимальным временем удвоения в несколько месяцев. Бесчисленные усилия по изоляции не смогли изолировать один из анаэробных метанотрофов, возможное объяснение может заключаться в том, что археи ANME и SRB имеют облигатное синтрофическое взаимодействие и поэтому не могут быть изолированы по отдельности.
В бентосных морских районах с сильным выбросом метана из ископаемых резервуаров (например, на холодных выходах , грязевых вулканах или отложениях газовых гидратов ) АОМ может быть настолько высоким, что хемосинтезирующие организмы, такие как нитчатые серные бактерии (см. Beggiatoa ) или животные (моллюски, трубчатые черви) с симбионтами Сульфидокисляющие бактерии могут процветать за счет большого количества сероводорода , производимого во время АОМ. Бикарбоната (HCO 3 — ) , полученная от отита может (я) получить поглощенную в осадках осаждения карбоната кальция или так называемых метан , полученные аутигенных карбонаты и (II) получают выпущен в покрывающей толщу воды. Полученные из метана аутигенные карбонаты, как известно, являются наиболее обедненными 13 C карбонатами на Земле, со значениями δ 13 C до -125 промилле .
Эффект Пастера
Эффект Пастера — это снижение потребления глюкозы и прекращение продукции молочной кислоты клеткой в присутствии кислорода. Биохимическая основа эффекта заключается в конкуренции за субстрат между пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и , превращающей пируват в лактат.
У пируватдегидрогеназы сродство гораздо выше и в обычных аэробных условиях она окисляет большую часть пировиноградной кислоты. Как только поступление кислорода уменьшается (анемии, нарушение кровообращения, спазм сосудов, тромбозы и т.п.) происходит следующее:
- внутримитохондриальные процессы дыхания не идут и НАДН в дыхательной цепи не окисляется,
- моментально накапливающийся в митохондриях НАДН тормозит цикл трикарбоновых кислот,
- ацетил-S-КоА не входит в ЦТК и вместе с НАДН ингибирует ПВК-дегидрогеназу.
В этой ситуации пировиноградной кислоте не остается ничего иного как превращаться в молочную.
При наличии кислорода ингибирование ПВК-дегидрогеназы прекращается и она, обладая большим сродством к пирувату, выигрывает конкуренцию.
Отличной иллюстрацией к сказанному служит чувствительность миокарда и нейронов к недостатку кислорода:
Роль лактатдегидрогеназы в клетке
В норме работу клеток нервной системы и миокарда при аэробных условиях обеспечивает большое количество митохондрий и поступление из крови субстратов для окисления – глюкозы, кетоновых тел, жирных кислот (только для миокарда), лактата, превращегося в пируват.
В основе высокой чувствительности этих органов к отсутствию кислорода лежит изоферментов лактатдегидрогеназы друг от друга. Рассмотрим это на прмиере ЛДГ-1 и ЛДГ-5.
Сердечный изофермент ЛДГ-1, обладая высоким сродством к молочной кислоте, переводит ее в пировиноградную, «стремясь» поднять концентрацию пирувата с целью его включения в цикл трикарбоновых кислот (только в аэробных условиях) и получения энергии для сокращения миокардиоцита. Поэтому миокард не образует лактат, но зато может использовать его для получения энергии, захватывая из крови, но только в аэробных условиях. Аналогично лактат используется нервной системой.
При нехватке кислорода свойства изофермента ЛДГ-1 не изменятся, он по-прежнему будет сдвигать реакцию в сторону продукции пировиноградной кислоты (на схеме «справа-налево»). Однако без кислорода «сгореть» в ЦТК пируват не может и выйти из клетки тоже не может, т.к. клеточные мембраны непроницаемы для него. Являясь кислотой, он закисляет цитозоль, изменяя активность ферментов и, возможно, как-то еще проявляет токсичность. Таким образом, происходят необратимые повреждения кардиомиоцита и нейрона – развивается инфаркт миокарда. или ишемический инсульт.
В тоже время изофермент скелетной мышцы ЛДГ-5 обладает высоким сродством к пирувату, при отсутствии кислорода в клетке быстро и эффективно превращает его в молочную кислоту, обратная же реакция практически не идет. Закисление саркоплазмы снижает работоспособность миоцита. Мышца, хоть и не в состоянии работать в таких условиях, все-таки сохраняет жизнеспособность. Причина в том, что в клетке молочная кислота не накапливается – при помощи монокарбоксилатных переносчиков (monocarboxylate transporters – MCTs) она проходит через клеточные мембраны и относительно быстро удаляется из мышцы. После «отключки» скелетная мышца вновь становится работоспособной через несколько минут.
Таким образом, в анаэробных условиях сильнее всего будут страдать сердечная мышца и нервная система, что, собственно говоря, и наблюдается в медицинской практике.
Степень аэробности среды
Степень аэробности среды характеризуется прежде всего ее окислительно-восстановительным потенциалом – физической величиной, выражаемой в вольтах и измеряемой посредством потенциометрии. В среде, максимально насыщенной кислородом, показатель может достигать 41. При насыщении среды водородом он приближается к нулю. Число 28 позволяет делать выводы о том, что процессы окисления и равновесия сбалансированы.
Наблюдается четкая зависимость между окислительно-восстановительным потенциалом среды и параметрами жизнедеятельности организмов. Таким образом, воздействуя на него и меняя на свое усмотрение, можно регулировать их численность. Однако не стоит забывать и об обратной зависимости: выделяя продукты обмена, а также используя адаптационные механизмы, микроорганизмы также могут вилять на окислительно-восстановительный потенциал среды, в которой они находятся.
История изучения[править | править код]
Первые геохимические свидетельства протекания окисления метана в анаэробных условиях были получены ещё в 1970-е годы при изучении профильного распределения метана, сульфатов и сероводорода в донных отложениях. Первыми из биологов исследовали процесс Зендер и Брок в —1980 годах. Ими была выдвинута гипотеза, что окисление протекает в два этапа, причём первый из них представляет собой обратный метаногенез. Позже гипотеза нашла ряд подтверждений и сейчас рассматривается как общепризнанная.
На рубеже 1990-х и 2000-х годов начался новый этап в изучении анаэробного окисления метана с активным привлечением молекулярных методов. Была установлена таксономическая принадлежность анаэробных метанотрофов, начато изучение их генома и кодируемых им ферментов. В 2006 году получены свидетельства, что окисление метана может быть сопряжено с восстановлением не только сульфатов, но и нитратов. Тем не менее, организмы, способные расти в среде с метаном в роли единственного источника углерода, до сих пор не выделены, неясной остаётся биохимия процесса.
Бескислородный этап энергетического обмена
|
Гликолиз – это анаэробный ферментативный путь расщепления глюкозы до молочной кислоты (лактата), сопровождающийся выделением энергии, запасаемой в виде АТФ. Идентичный гликолизу процесс молочнокислого брожения характерен для многих микроорганизмов. У высших животных, грибов и растений гликолиз является необходимой стадией подготовки сахаров для полного окислительного расщепления до СО2 и Н2О в митохондриях в процессе клеточного дыхания. У млекопитающих гликолиз наиболее интенсивно протекает в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, а также в клетках раковых опухолей. |
Последовательные реакции гликолиза катализируются 11 ферментами, которые локализованы в гиалоплазме. Условно гликолиз можно разделить на 2 стадии: на первой стадии глюкоза с затратой АТФ превращается в глицеральдегидфосфат, а на второй в результате окислительно-восстановительных реакций образуются АТФ и молочная кислота. Накапливаемый в качестве промежуточного продукта гликолиза восстановленный НАДН окисляется при образовании молочной кислоты до НАД+, который снова возвращается в гликолиз. При наличии достаточного количества кислорода НАДН может окисляться в дыхательной цепи митохондрий. В таком случае гликолиз заканчивается на стадии образования не молочной, а пировиноградной кислоты (пирувата), которая вступает в цикл Кребса и полностью окисляется до СО2.
При распаде одной молекулы глюкозы затрачивается 2 и образуется 4 молекулы АТФ, т.е. суммарный энергетический выход гликолиза составляет 2 молекулы АТФ. Необходимая для этого энергия выделяется в результате внутримолекулярного окисления альдегидной группы до карбоксильной. В виде АТФ запасается около 30% выделяемой при этом энергии, что, однако, составляет только 5% энергии, которую можно получить при полном окислении глюкозы до СО2 и Н2О. Таким образом, гликолиз энергетически менее выгоден, чем дыхание. В гликолиз включаются и другие гексозы (галактоза, фруктоза), пентозы и глицерин. Субстратом гликолиза у животных и грибов может быть гликоген (этот процесс называется гликогенолизом), а у растений – крахмал.
По механизму, аналогичному гликолизу, протекает процесс брожения у различных микроорганизмов. Поскольку живые организмы, по-видимому, впервые появились на Земле в то время, когда ее атмосфера была лишена кислорода, анаэробное брожение следует рассматривать как простейший биохимический механизм получения энергии из питательных веществ. Брожению подвергаются углеводы (гексозы, пентозы), спирты, органические кислоты и азотистые основания. В зависимости от типа брожения его продуктами могут быть спирты (этиловый и др.), органические кислоты (муравьиная, уксусная, молочная, пропионовая, масляная), ацетон, СО2, а в ряде случаев – молекулярный водород. По виду образуемых продуктов брожение подразделяют на спиртовое, молочнокислое, пропионовокислое и т.д., что легло в основу названия ряда групп бактерий (молочнокислые, маслянокислые, пропионовокислые и т.д.). В процессе спиртового или молочнокислого брожения из одной молекулы глюкозы образуются по две молекулы пирувата, АТФ и НАДН. Поскольку НАДН необходимо окислить и вернуть в цикл брожения, пируват восстанавливается им до молочной кислоты (лактата) или этилового спирта.
Брожение играет важную роль в круговороте веществ в природе (анаэробная деградация целлюлозы и других органических веществ), а также широко применяется в практике. В течение многих веков спиртовое брожение используется в виноделии, пивоварении, выпечке хлеба (а в последнее время – при получении топлива); молочнокислое – для получения кисломолочных продуктов, при квашении капусты, солении огурцов, силосовании кормов для скота; пропионовокислое – в сыроделии; ацетонно-бутиловое – для получения растворителей и т.д.
Методы анаэробной очистки сточных вод
Поскольку процесс анаэробной очистки осуществляется без участия кислорода, фактически он представляет собой брожение, либо ферментацию, в процессе которых наблюдается выработка метана.
Органические соединения при этом распадаются на более простые, проходя несколько стадий. Каждая из них происходит с участием микроорганизмов, отличающихся разным характером воздействия.
- Фаза гидролиза. Позволяет разложить сложные углеводороды на более простые составляющие и воду. Бактерии способствуют тому, что белки распадется до аминокислот, из жиров получаются жирные кислоты, происходит образование сахара из углеводов.
- Фаза промежуточного окисления продолжает процесс преобразования органических соединений, образуя альдегиды, спирты и органические кислоты.
- Третья фаза обеспечивает возможность осуществить окисление всех продуктов, участвующих в реакция до уксусной кислоты и водорода.
- На заключительной фазе происходит включение в процесс метанобразующих бактерий. Они питаются продуктами распада, выделенных в результате предыдущих реакций, выделяя при этом углекислый газ и метан. Прирост илистой массы при этом несущественен.
Фазы анаэробной очистки тесно связаны между собой, из-за чего нарушение одной из них неизбежно приведет к дестабилизации всего процесса в целом. Это объясняется тем, что питательной средой для микроорганизмов на каждой следующей стадии становятся вещества, произведенные на предыдущих.
Для того чтобы процесс очистки происходил более эффективно, важно ответственно отнестись к определению качественного состава органики стока. Белки, жиры и углеводы разлагаются с разной скоростью, зная их процентное содержание можно эффективнее рассчитывать и контролировать описанный процесс
На скорость протекания стадий, в особенности двух последних в значительной степени влияет уровень кислотности среды.
В сочетании с сульфатредукцией
Три механизма анаэробного окисления метана (АОМ). Первый метод (вверху) осуществляется консорциумом анаэробных метанотрофных (ANME) архей из клад 1,2a, 2b и 2c и сульфатредуцирующих бактерий (SRB). Окисление метана происходит в ANME, где электроны передаются непосредственно в SRB, который выполняет восстановление сульфата. . Второй метод (в центре) связывает окисление метана с восстановлением нитратов, которое осуществляется консорциумом архей ANME и бактерий Anammox. Третий механизм (внизу) также связывает окисление метана с восстановлением нитратов, но его опосредуют археи ANME и бактерии NC10. В отличие от первых двух механизмов, и археи ANME, и бактерии NC10 конкурируют за метан.
Общая реакция такова:
- CH4 + ТАК42− → HCO3− + HS− + H2О
Сульфатно-управляемый АОМ опосредуется синтрофным консорциумом метанотрофных археи и сульфатредуцирующие бактерии. Часто они образуют небольшие агрегаты, а иногда и объемные маты. Партнер архей сокращенно АНМЕ, что означает «анаэробный метанотроф». ANME очень тесно связаны с метаногенными археями, и недавние исследования предполагают, что AOM является ферментативным обращением метаногенез. До сих пор плохо изучено, как взаимодействуют синтрофические партнеры и какие промежуточные продукты обмениваются между архейной и бактериальной клеткой. Исследованию АОМ препятствует тот факт, что ответственные организмы не были изолированы. Это связано с тем, что эти организмы демонстрируют очень медленные темпы роста с минимальным временем удвоения в несколько месяцев. Бесчисленные усилия по изоляции не позволили изолировать один из анаэробных метанотрофов, возможное объяснение может заключаться в том, что у архей ANME и SRB есть обязательный синтрофное взаимодействие и поэтому не может быть выделено индивидуально.
В бентосный морские районы с сильными выбросами метана из ископаемых резервуаров (например, на холодные просачивания, грязевые вулканы или же газовый гидрат депозитов) AOM может быть настолько высоким, что хемосинтетический такие организмы, как нитчатые серные бактерии (см. Beggiatoa) или животных (моллюски, трубчатые черви) с симбионт сульфидокисляющие бактерии могут процветать на большом количестве сероводород которые производятся во время AOM. Производство бикарбонат из АОМ может привести к осаждению карбонат кальция или так называемый аутигенный карбонаты. Эти аутигенные карбонаты, как известно, являются наиболее 13Карбонаты обедненные углеродом на Земле, с δ13Значения C до -125 промилле сообщил.
Что такое гликолиз
В общих чертах, гликолиз — это процесс, который происходит в цитоплазме всех клеток: от низших бактерий до высших млекопитающих — людей. Для некоторых это единственный метаболический путь доставки энергии клетке — например, для бактерий, для других же это метаболический путь, в который «сливаются» и другие метаболиты — белки и липиды.
Гликолиз — это основной путь расщепления глюкозы в нашем организме, основное биологическое значениеэтого процесса заключается в получении энергии и других продуктов обмена.
 Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
При наличии кислорода этот процесс называется аэробным гликолизом — конечным продуктом выступают CO2 и H2O,
Гликолиз представляет собой серию реакций, в которых одна молекула глюкозы распадается на две молекулы пирувата. Но так происходит не всегда, в случаях когда доступ кислорода в этой реакции затруднен, проще говоря, в анаэробных условиях, то пируват превращается в лактат или спирт.
Механизмы анаэробного метаболизма: гликолиз в анаэробных условиях
В анаэробных условиях O2 отсутствует. Отсутствие конечного субстрата O2 ингибирует активность дыхательных структур (до этого они неактивны), и таким образом конечным продуктом распада глюкозы в анаэробных условиях является лактат,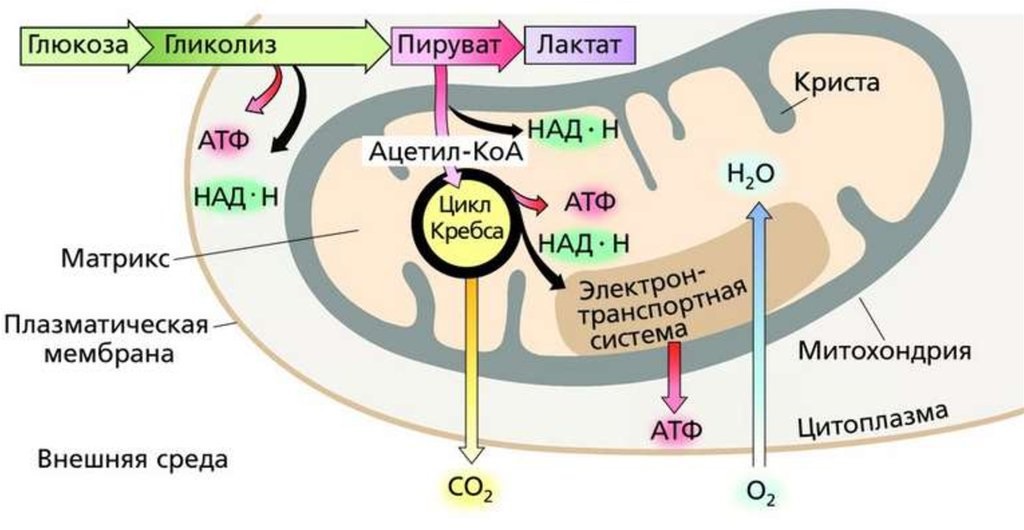
Анаэробный распад глюкозы в физиологических условиях наблюдается в эритроцитах (без митохондрий) и в сильно сокращающихся мышцах (недостаточное кровоснабжение кислородом), это наблюдается при сильной физической работе — присутствует истощение O2 в мышечных клетках (в форме оксимиоглобина).
Лактат в мышечных клетках приводит к мышечной лихорадке, которая преодолевается неинтенсивной мышечной активностью, направленной на полное расщепление лактата в мышцах, до CO2 , H2O и H2 в результате аэробного гликолиза.
При патологических состояниях и онкологических заболеваниях, у многих людей наблюдается так называемый эффект Пастера, при котором клетки из-за уменьшенного поступления крови или кислорода переключаются на анаэробный распад глюкозы, связанный с повышенным ее потреблением (повышенная экспрессия трансмиттеров глюкозы GLUT1 ) и гипогликемией.
Анаэробный гликолиз, как при физиологических, так и при патологических состояниях, характеризуется повышенным уровнем конечного продукта в результате расщепления его лактата в плазме крови — лактатемией, что может привести к ацидозу.
Дальнейшее расщепление лактата
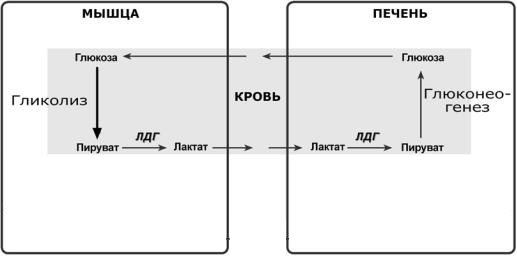
Лактат метаболизируется из печени в пируват, катализируя реакцию в обратном направлении, и глюкоза синтезируется пируватом с использованием ферментов глюконеогенеза в печени через цикл Кори (лактатный цикл).
Вот в этой схеме и кроется ответ на вопрос о том, как влияет анаэробный гликолиз на производство энергии, ведь мы видим, что наша молочная кислота, образовавшаяся в мышцах, через кровь попадает в печень и участвует в процессе глюконеогенеза — создания глюкозы из неуглеводных продуктов.
В сочетании с восстановлением нитратов и нитритов
Общие реакции:
- CH4 + 4НО3− → CO2 + 4НО2− + 2H2О
- 3CH4 + 8НО2− + 8H+ → 3CO2 + 4N2 + 10H2О
Недавно было показано, что ANME-2d отвечает за АОМ, управляемый нитратами. Анме-2д, названный Methanoperedens nitroreducens, способен выполнять АОМ, управляемый нитратами, без организма-партнера посредством обратного метаногенеза с нитратом в качестве конечного акцептора электронов, используя гены восстановления нитрата, которые были переданы латерально от бактериального донора. Это также был первый полный путь обратного метаногенеза, включая mcr и мер гены.
В 2010 году омикс-анализ показал, что восстановление нитрита может быть связано с окислением метана одним видом бактерий, NC10, без участия архейного партнера.
В сочетании с восстановлением нитратов и нитритов
Общие реакции:
- CH 4 + 4 NO 3 — → CO 2 + 4 NO 2 — + 2 H 2 O
- 3 CH 4 + 8 NO 2 — + 8 H + → 3 CO 2 + 4 N 2 + 10 H 2 O
Недавно было показано, что ANME-2d отвечает за АОМ, управляемый нитратами. ANME-2d, названный Methanoperedens nitroreducens , способен выполнять АОМ, управляемый нитратами, без организма-партнера посредством обратного метаногенеза с нитратом в качестве концевого акцептора электронов, используя гены восстановления нитратов, которые были переданы латерально от бактериального донора. Это также был первый полный путь обратного метаногенеза, включающий гены mcr и mer .
В 2010 году омики , особенно метагеномические , анализ показали, что восстановление нитрита может быть связано с окислением метана одним бактериальным видом Candidatus Methylomirabilis oxyfera ( тип NC10 ), без необходимости в архейном партнере.
Гликолиз
Анаэробное превращение глюкозы локализуется в цитозоле и включает два этапа из 11 ферментативных реакций.
Первый этап гликолиза
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент глюкозофосфат-изомераза). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
- при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза,
- при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез глицеррол-3-фосфата для образования фосфатидной кислоты и далее тривцилглицеролов.
Второй этап гликолиза
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата до кислоты и присоединение к ней фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (использование энергии электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ с образованием пировиноградной кислоты и АТФ.
Последняя реакция бескислородного окисления глюкозы, одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы
Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях
| У плода и детей первых месяцев жизни преобладает анаэробный распад глюкозы, в связи с чем концентрация молочной кислоты в крови у них выше чем у взрослых. |
| При наличии кислорода пировиноградная кислота переходит в митохондрию и превращается в ацетил-S-КоА. |
Анаэробное окисление: брожение и гниение
Брожение представляет анаэробный процесс, в ходе которого происходит превращение органических веществ, не содержащих азот в более простые соединения посредством включения микроорганизмов. При этом осуществляется выделение энергии и накопление продуктов неполного окисления. Главная функция брожения – образование энергии, поддерживающей процессы жизнеобеспечения внутри микроорганизмов.
Также как брожение, гниение представляет собой процесс разложения органических веществ. Однако в отличие от брожения, гниение осуществляется под воздействием аммонификаторов и сопровождается выделением газообразного аммиака. Процесс происходит главным образом в белковых соединениях, содержащих азот.
Примечания[править | править код]
- ↑
- Hinrichs K.U., Hayes J.M., Sylva S.P., Brewer P.G., DeLong E.F. Methane-consuming archaebacteria in marine sediments // Nature, 29 апреля 1999, № 398. Стр. 802—805.
- Boetius, A., K. Ravenschlag, C. J. Schubert, D. Rickert, F. Widdel, A. Gieseke, R. Amann, B. B. Jørgensen, U. Witte, and O. Pfannkuche. Microscopic identification of a microbial consortium apparently mediating anaerobic methane oxidation above marine gas hydrate // Nature, 2000, № 407. Стр 623—626.
- ↑ Orphan V. J., House C. H., Hinrichs K.-U., McKeegan K. D., DeLong E. F. Methane-Consuming Archaea Revealed by Directly Coupled Isotopic and Phylogenetic Analysis // Science, 2001. Vol. 293. P. 484—487.
- Hallam S. J., Putnam N., Preston C. M., Detter J. C., Rokhsar D., Richardson P. M., DeLong E. F. Reverse Methanogenesis: Testing the Hypothesis with Environmental Genomics // Science, 2004. Vol. 305. P. 1457—1462.
- Hoehler T. M., Alperin M. J. Anaerobic methane oxidation by a methangen-sulfate reducer consortium: geochemical evidence and biochemical considerations. In M. E. Lidstrom, and F. R. Tabita (ed.), Microbial growth on C1 compounds. Kluwer Academic Publishers, Dordrecht, The Netherlands. 1996.
- ↑ Valentine D. L., Reeburgh W. S New perspectives on anaerobic methane oxidation // Environ. Microbiol. 2000, № 2. Стр. 477—484.
- Nauhaus K., Boetius A., Kruger M., Widdel F. in vitro demonstration of anaerobic oxidation of methane coupled to sulphate reduction in sediment from a marine gas hydrate area // Environ. Microbiol. 2002, № 4. Стр. 296—305.
- Sorensen K.B., Finster K., Ramsing N.B. Thermodynamic and Kinetic Requirements in Anaerobic Methane Oxidizing Consortia Exclude Hydrogen, Acetate, and Methanol as Possible Electron Shuttles // Microb. Ecol., 2001. Vol. 42. P. 1-10.
- Raghoebarsing A.A., Pol A., van de Pas-Schoonen K.T., Smolders A.J., Ettwig K.F., Rijpstra W.I., Schouten S., Damsté J.S., Op den Camp H.J., Jetten M.S., Strous M. A microbial consortium couples anaerobic methane oxidation to denitrification // Nature, 13 апреля 2006, № 440. Стр. 918—921.
- ↑
- Alperin M. J., Reeburgh W. S. Inhibition experiments on anaerobic methane oxidation // Applied and Environmental Microbiology, vol. 50, № 4, 1985. Стр. 940—945.
- ↑
- Losekann T., Knittel K., Nadalig T., Fuchs B., Niemann H., Boetius A., Amann R. Diversity and Abundance of Aerobic and Anaerobic Methane Oxidizers at the Haakon Mosby Mud Volcano, Barents Sea // Applied and Environmental Microbiology, 2007. Vol. 73, № 10. P. 3348—3362.
- Orphan V.J., House C.H., Hinrichs K.-U., McKeegan K.D., DeLong E.F. Multiple archaeal groups mediate methane oxidation in anoxic cold seep sediments // PNAS, 2002. Vol. 99. No 11. P. 7663-7668
- ↑
- ↑ Moran J. J., House C. H., Freeman K. H., Ferry J. G. Trace methane oxidation studied in several Euryarchaeota under diverse conditions // Archaea, 2005. Vol. 1. P. 303—309.
- Harder J. Anaerobic methane oxidation by bacteria employing 14C-methane uncontaminated with 14C-carbon monooxide // Mar. Geol. 1997. № 137. Стр. 13-23.
- Kajikawa H., Valdes C., Hillman K., Wallace R. J., Newbold C. J. Methane oxidation and its coupled electron-sink reactions in ruminal fluid // Letters in Applied Microbiology, 2003. Vol. 36, 354—357.
В сочетании с сульфатредукцией
Три механизма анаэробного окисления метана (АОМ). Первый метод (вверху) осуществляется консорциумом анаэробных метанотрофных (ANME) архей из клад 1,2a, 2b и 2c и сульфатредуцирующих бактерий (SRB). Окисление метана происходит в ANME, где электроны передаются непосредственно в SRB, который выполняет восстановление сульфата. . Второй метод (в центре) связывает окисление метана с восстановлением нитратов, которое осуществляется консорциумом архей ANME и бактерий Anammox. Третий механизм (внизу) также связывает окисление метана с восстановлением нитратов, но его опосредуют археи ANME и бактерии NC10. В отличие от первых двух механизмов, и археи ANME, и бактерии NC10 конкурируют за метан.
Общая реакция такова:
- CH4 + ТАК42− → HCO3− + HS− + H2О
Сульфатно-управляемый АОМ опосредуется синтрофным консорциумом метанотрофных археи и сульфатредуцирующие бактерии. Часто они образуют небольшие агрегаты, а иногда и объемные маты. Партнер архей сокращенно АНМЕ, что означает «анаэробный метанотроф». ANME очень тесно связаны с метаногенными археями, и недавние исследования предполагают, что AOM является ферментативным обращением метаногенез. До сих пор плохо изучено, как взаимодействуют синтрофические партнеры и какие промежуточные продукты обмениваются между архейной и бактериальной клеткой. Исследованию АОМ препятствует тот факт, что ответственные организмы не были изолированы. Это связано с тем, что эти организмы демонстрируют очень медленные темпы роста с минимальным временем удвоения в несколько месяцев. Бесчисленные усилия по изоляции не позволили изолировать один из анаэробных метанотрофов, возможное объяснение может заключаться в том, что у архей ANME и SRB есть обязательный синтрофное взаимодействие и поэтому не может быть выделено индивидуально.
В бентосный морские районы с сильными выбросами метана из ископаемых резервуаров (например, на холодные просачивания, грязевые вулканы или же газовый гидрат депозитов) AOM может быть настолько высоким, что хемосинтетический такие организмы, как нитчатые серные бактерии (см. Beggiatoa) или животных (моллюски, трубчатые черви) с симбионт сульфидокисляющие бактерии могут процветать на большом количестве сероводород которые производятся во время AOM. Производство бикарбонат из АОМ может привести к осаждению карбонат кальция или так называемый аутигенный карбонаты. Эти аутигенные карбонаты, как известно, являются наиболее 13Карбонаты обедненные углеродом на Земле, с δ13Значения C до -125 промилле сообщил.
Классификация анаэробов
Различают два основных типов анаэробов:
- Факультативы (кишечная палочка, стафилококк, стрептококк, шигелл). Приспособлены к существованию как в кислородной, так кислородсодержащей среде).
- Облигатные существуют исключительно в бескислородной среде. Малейший контакт с этим газом приводит к гибели этих организмов.
Облигатные микроорганизмы также делятся на две категории:
- Клостридии – возбудители развития ряда инфекций, в частности бутулизма, столбняка. Образуют споры.
- Неклостридиальные – не представляющие опасности как для человека, так и других живых существ. Это – бактериоды, эубактерии, пейллонеллы, пептококки. Не образуют споры.
В жидкой питательной среде факультативы равномерно распределены по всем ее слоям, облигатные же, избегая контакта с кислородом, сосредоточены в нижних.
