Драг-дизайн: как в современном мире создаются новые лекарства
Содержание:
- Увеличение времени работы устройств
- Улучшение работы медицинских организаций
- Что, где и когда: почему новое лекарство – так актуально?
- Как принимать
- Два направления технологии изготовления ЛС
- Особенности фармацевтической технологии
- Кошелек или жизнь
- III ФАЗА Клинического Исследования
- Оценка
- Сканирование и моделирование тела
- Что такое KFU-01
- Разработка лекарств и медицинских устройств
- Расходы
- Вычислительные инициативы
- Персонализированная информация о здоровье
- II ФАЗА Клинического Исследования
- Геномная медицина
- Степень успеха
- Регистрация фармацевтических препаратов: подготовительный этап
Увеличение времени работы устройств
Philips запустила глобальную программу профилактического обслуживания, которая объединяет данные с более чем 15 тыс. медицинских устройств. Эти данные визуализировали в цифровых моделях оборудования. Компания надеется, что цифровые двойники смогут увеличить время безотказной работы медоборудования и помочь инженерам настраивать новое оборудование для нужд разных клиентов.
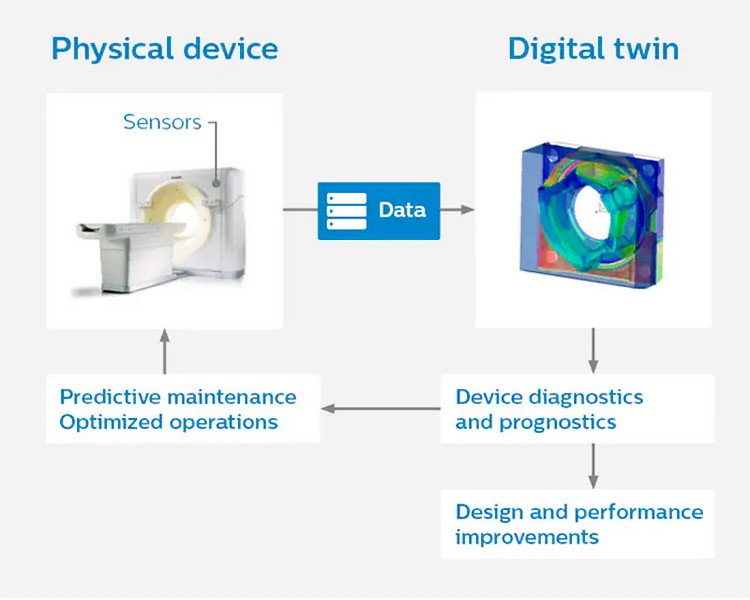
Цифровые двойники оборудования от Philips
(Фото: philips.com)
Между тем регулирующие органы ведут мониторинг обслуживания оборудования с помощью цифровых двойников. Например, Sysmex включила тестирование производительности в свой анализатор крови.
Улучшение работы медицинских организаций
Цифровые двойники также помогают улучшить качество обслуживания в медучреждениях. Исследовательская компания Gartner использует термин «цифровой двойник» организации, чтобы описать процесс моделирования того, как она работает, для улучшения своих основных процессов. Процесс обычно включает использование интеллектуального анализа данных для выявления возможных изменений в бизнес-процессах.
Инициатива GE Healthcare по виртуализации больниц использует модули для оценки изменений в операционной стратегии, возможностях, персонала, чтобы объективно определить, какие действия следует предпринять организации. Например, на платформе есть модули для оценки влияния конфигурации кроватей на уровень оказания медицинской помощи, оптимизации графиков операций, улучшения дизайна медицинского учреждения и оптимизации численности персонала. Это позволяет управляющим больниц проверять различные идеи без запуска пилотного проекта. По словам представителей GE, десятки организаций уже используют эту платформу.
Цифровые близнецы также могут помочь лицам, осуществляющим уход за больными, собирать и находить информацию от разных врачей. Сами медики могут использовать их, чтобы получать данные о болезнях пациента от других специалистов. Siemens Healthineers сотрудничает с Медицинским университетом Южной Каролины для улучшения распорядка дня в больнице с помощью анализа рабочих процессов. Одной из задач работы стало сокращение времени лечения пациентов, перенесших инсульт, поскольку для них время имеет решающее значение при восстановлении.
Что, где и когда: почему новое лекарство – так актуально?
Новый препарат – это разработка ученых Казанского федерального университета. Сегодня для снятия боли и воспаления при хронических дегенеративных изменениях в суставах применяют ибупрофен, диклофенак и другие аналогичные препараты. Однако все они дают краткосрочный эффект, а главное – оказывают негативное влияние на сердце и пищеварительную систему.
Остеоартроз и ревматоидный артрит, при которых часто используются НПВС, поражают около трети взрослого населения во всем мире. Препараты обладают высокой гастро- и кардиотоксичностью, поэтому их сложно назвать эффективными. Ревматологи назначают существующие нестероидные противовоспалительные медикаменты с опаской и исключительно на короткий период. Новое лекарство лишено этих недостатков, и вот почему.
Как принимать
Новый препарат желательно будет принимать по назначению врача. По статистике, около двух третьих из 300 млн людей, принимающих НПВС ежегодно, не обращаются за медицинской помощью и самостоятельно принимают решение. Неудивительно, что очень часто развиваются нежелательные последствия, в первую очередь эрозии и язвы желудочно-кишечного тракта с опасными для жизни кровотечениями.
Инновационный препарат с высоким противовоспалительным и противоболевым действием лишен этих недостатков. Поэтому при самостоятельном приеме риски будут ниже. Тем не менее, экспериментировать не стоит, поэтому разработчики будут традиционно рекомендовать предварительную консультацию с врачом.
Даже если препарат позиционируется как безопасный, посоветуйтесь с врачом
Сегодня в России успешно практикуют самые разные методы лечения артроза, например трансплантацию хондроцитов. Новое лекарство от воспалений – еще одно направление. После успешных испытаний на животных медпрепарат проходит клинические исследования. Ориентировочная дата появления на рынке – 2023 года. Российские ученые рассчитывают начать продажи международных лицензий на его выпуск. Насколько приживется лекарство на нашем рынке и поможет ли при артрозе – покажет время.
Два направления технологии изготовления ЛС
Технология изготовления лекарственных средств делятся на промышленную (заводскую) и аптечную технологию лекарственных средств и имеют общую теоретическую основу.
Заводская технология лекарств (ЗТЛ)
Применяется при массовом промышленном изготовлении лекарственных средств. Для целесообразности переноса производства в заводские условия должны присутствовать такие факторы как:
- Массовое потребление лекарств, делающее осмысленным внедрение комплексной механизации и автоматизации процесса производства, которое позволяет обеспечить высокое качество готовых препаратов;
- Длительная сохранность готового препарата, при которой лекарство сохраняет свои качественные характеристики на всем пути от производителя к больному человеку;
- Возможность стандартизации процесса производства с помощью машинной техники.
Производителей можно разделить на две категории: галеново-фармацевтические и химико-фармацевтические заводы. Между собой они различаются мощностью и номенклатурой производства, технологическим оборудованием, наличием нескольких линий производства и так далее.
Фармацевтическое производство функционирует в рамках системы менеджмента качества (СМК), а у передовых производителей есть свои подразделения исследования и разработки (R&D).
Аптечная технология лекарств (АТЛ)
Аптечное производство предполагает изготовление лекарств по индивидуальным прописям. Такие лекарства обычно имеют небольшой срок годности, что делает невозможным их массовое приготовление. Одним из преимуществ такого подхода является индивидуальность состава лекарства, которая позволяет учесть особенности организма больного при определении вида и количества компонентов.
Особенности фармацевтической технологии
Технологический процесс включает совокупность определенных действий.
Пример: при производстве таблеток технологический процесс включает стадии подготовки, гранулирования, таблетирования, упаковки и маркировки.
Процессы технологии изготовления лекарственных препаратов можно разделить на шесть групп:
- Механические. Встречаются при работе с твёрдыми материалами и включают такие действия как измельчение, дозирование, смешивание, прессование и другие;
- Гидромеханические. Встречаются при работе с газообразными веществами или жидкостями и включают такие действия как разделение жидких и твердых фаз, смешивание жидкостей, очистка газов от микроорганизмов или пыли и другие;
- Тепловые. Встречаются при работе с веществами, требующими изменения температурного режима. Включают такие действия как охлаждение, нагревание, приводящие к плавлению, испарению, конденсации и так далее;
- Массообменные. Встречаются в случаях, когда при проведении диффузии меняется состояние компонентов лекарственной смеси — из-за этого такие процессы иногда называют «диффузные». Включают такие действия как сушка, растворение, абсорбция, перегонка и другие;
- Химические. Предполагают образование новых химических соединений или изменение строения веществ, что приводит к изменению их химических свойств;
- Биотехнологические. Встречаются при производстве лекарственных средств с клеточными структурами животных или растений, микроорганизмов в составе.
Один технологический цикл может включать сразу несколько процессов разных типов, например, гранулирование может включать в себя механические, гидромеханические и массообменные процессы.
Кошелек или жизнь
168 млн рублей — много это или мало? Для сравнения, на эту сумму можно построить детский сад на 168 мест (место для одного ребенка стоит примерно 1 млн рублей). А сколько стоит жизнь человека? Во многих цивилизованных странах прокламируется, что человеческая жизнь бесценна. Но по факту это не так. Стоимость жизни — экономическая величина, которую используют для количественной оценки выгоды от предотвращения смертельного исхода. В области общественных наук это предельная стоимость предотвращения смерти при определенных обстоятельствах. Часто она включает также качество жизни, ожидаемое время оставшейся жизни и потенциальный заработок. Последнее используется для страховых выплат или компенсаций после гибели человека. Поэтому в разных странах стоимость жизни значительно отличается. Например, в США она составляет примерно 9,6 млн долларов, в Германии — 1,65 млн евро (~2 млн долларов), в Индии — 0,64 млн долларов. Что касается России, по состоянию на 2020 год, стоимость статистической жизни как 4,7 млн рублей (75,9 тыс. долларов по курсу 2019 года). По , более оптимистичной, модели — 15,7 млн для женщин и 18,2 млн для мужчин (218 и 253 тыс. долларов соответственно).
Теперь помещаем на одну чашу весов лекарство за 2,1 млн, а на другую — десятки тысяч… Вопрос, почему даже зарегистрированные дорогостоящие лекарственные препараты неохотно предоставляются госучреждениями, отпадает сам собой. Возможно, одним из вариантов частичного решения этой проблемы могло бы стать добровольное страхование новорожденного ребенка в тех случаях, когда родители имеют генетические аномалии. Также не помешает более тщательный выбор партнеров — с предварительным скринингом на наследственные заболевания до планируемого зачатия вместо игры в орлянку с генетикой.
III ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат и основная цель получить результат эффективности и безопасности
препарата.
Задачи:
- подтвердить эффективность и безопасность;
- доказать безопасность на большой популяции;
- получение полной информации, необходимой для терапевтического применения
исследуемого препарата; - основание для регистрации исследуемого препарата.
Дизайн:
- интернациональные/мультицентровые;
- заслепленные;
- сравнительные (группы контроля: плацебо/стандарт лечения).
После того, как в ходе исследований фазы III фармацевтическая компания подтвердила
эффективность и безопасность нового препарата, формируется регистрационное досье
препарата, где описываются методология и результаты доклинических исследований и трех
фаз клинических исследований лекарственного препарата, особенности производства, состав лекарственного препарата и его срок годности. Регистрационное досье оформляют и направляют в уполномоченный орган здравоохранения, осуществляющий регистрацию новых препаратов. После получения регистрационного удостоверения лекарственный препарат выводится на рынок лекарственных средств и поступает в аптеки.
Оценка
Характер проекта разработки лекарственного препарата характеризуется высокой коэффициент отсева, большие капитальные затраты и длительные сроки. Это делает оценку таких проектов и компаний сложной задачей. Не все методы оценки могут справиться с этими особенностями. Наиболее часто используемые методы оценки: чистая приведенная стоимость с поправкой на риск (rNPV), деревья решений, реальные варианты, или же сопоставимые.
Наиболее важными факторами создания стоимости являются стоимость капитала или используемая ставка дисконтирования, фаза такие атрибуты, как продолжительность, процент успеха и затраты, а также прогнозируемые продажи, включая стоимость товаров, а также расходы на маркетинг и продажи. Менее объективные аспекты, такие как качество управления или новизна технологии, должны быть отражены в денежные потоки оценка.
Сканирование и моделирование тела
Платформа от американской Q Bio — Gemini Digital Twin — позволяет сканировать все тело за 15 минут без радиационного излучения, используя модели вычислительной физики, которые более точны, чем обычная МРТ. Компания уже получила более $80 млн от венчурных фондов в сфере медицины Andreessen Horowitz, Kaiser Foundation Hospitals и других. Q Bio также работает над улучшением этих моделей, используя данные о генетике, анатомии, образе жизни и историях болезни пациентов.
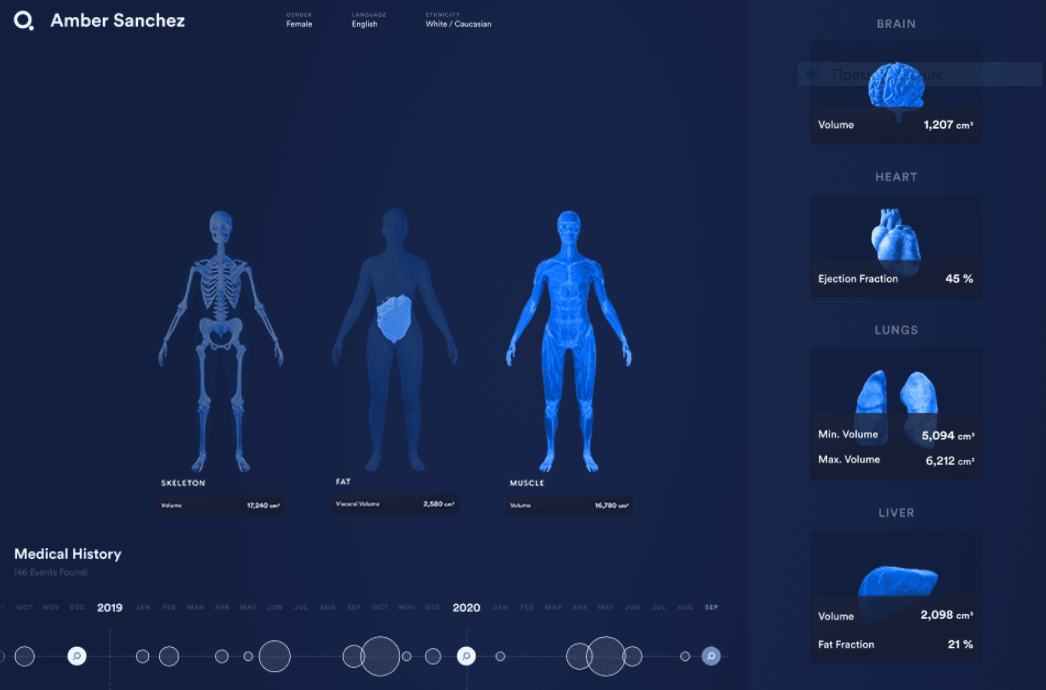
Цифровой двойник в Gemini Digital Twin
(Фото: Q Bio)
Обычные скелеты не могут отражать особенности тела отдельного человека. Немецкая компания Virtonomy разработала библиотеку таких вариаций. Производители могут использовать их при испытаниях любых новых устройств, чтобы выяснить, как эти вариации влияют на производительность и безопасность медоборудования.
Что такое KFU-01
Молекула нового нестероидного противовоспалительного средства, запатентованная Казанским университетом, называется KFU-01. Попадая в организм человека, это пролекарство распадается под действием биохимических факторов на два активных компонента:
- напроксен (непосредственно НПВС);
- пиридоксин (форма витамина В6).
Оба компонента обладают уникальным синергетическим действием, при этом они абсолютно безопасны для пищеварения и сердечно-сосудистой системы. Исследования препарата на животных подтвердили: препарат оказывает эффективное противовоспалительное действие при остром и хроническом воспалении, а также хорошо снижает боль – не слабее, чем традиционные обезболивающие препараты.
Новый препарат не оказывает негативного воздействия на слизистую оболочку желудка
Разработка лекарств и медицинских устройств
Цифровые двойники могут улучшить разработку, тестирование и мониторинг новых медицинских устройств и лекарств. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США запустило программу по внедрению различных типов цифровых подходов в фармацевтике. В ведомстве признают, что на сегодняшний день препараты от самых распространенных болезней остаются неэффективными для 35–78% пациентов.
Стартап Unlearn.ai, учрежденный выходцами из фармкомпании Pfizer, представил платформу машинного обучения DiGenesis для создания профилей цифровых двойников пациентов, получив $12 млн на ее развитие. Платформа в перспективе позволит тестировать новые препараты на цифровых моделях пациентов.
FDA также создает нормативную базу, позволяющую компаниям сертифицировать и продавать программное обеспечение как медицинское устройство. Основная идея состоит в том, чтобы создать цифрового двойника для конкретного пациента из различных источников данных, включая лабораторные тесты, ультразвук, устройства визуализации и генетические тесты. Кроме того, цифровые близнецы также могут помочь оптимизировать программное обеспечение в медицинских устройствах: кардиостимуляторах или автоматических инсулиновых помпах.
Исследователи из американского штата Оклахома работали с системой анализа Ansys над созданием цифрового двойника для улучшения доставки лекарств в легкие. Работа велась в рамках проекта Virtual Human System. Ученые обнаружили, что только около 20% препаратов попадают в целевые области легких. Цифровые двойники позволили исследователям изменить размер частиц и характеристики состава препаратов, чтобы повысить эффективность доставки до 90%.
В России ученые из Балтийского федерального университета имени Канта, Санкт-Петербургского НИИ фтизиопульмонологии и Курского государственного университета построили математическую модель метаболизма лекарства для лечения острых лейкозов у детей — меркаптопурина — в клетках печени. Эта модель позволила предсказать интервал концентраций препарата для наиболее желательного эффекта от лечения. Как объяснили разработчики, математическая модель работает как «цифровой двойник» пациента. Зная физические параметры человека перед началом химиотерапии, медики могут провести расчеты и сделать вывод о том вызовет ли она токсические эффекты или нет.

Индустрия 4.0
Как ученые и врачи используют цифровых двойников человека
Расходы
В одном исследовании 2010 года капитализированные и наличные затраты на вывод на рынок одного нового препарата оценивались примерно в 1,8 млрд долларов США и 870 млн долларов США соответственно. Медиана смета расходов 2015-16 гг исследований для разработки 10 противораковых препаратов была 648000000 $. В 2017 году средняя стоимость основного исследования по всем клиническим показаниям составила 19 миллионов долларов.
Средняя стоимость (в долларах 2013 г.) каждого этапа клинических исследований составила 25 миллионов долларов США для исследования безопасности фазы I, 59 миллионов долларов США для рандомизированного контролируемого исследования эффективности фазы II и 255 миллионов долларов США для основного исследования фазы III, чтобы продемонстрировать его эквивалентность или превосходство. к существующему одобренному препарату, возможно, до 345 миллионов долларов. Средняя стоимость проведения основного исследования фазы III на 2015–2016 гг. На кандидате от инфекционного заболевания составила 22 миллиона долларов.
Полная стоимость вывода на рынок нового лекарства (т. Е. Нового химического соединения ) — от открытия до клинических испытаний и до утверждения — сложна и спорна. По данным обзора 106 кандидатов в лекарственные препараты, оцененного в ходе клинических испытаний, общие капитальные затраты для производителя, имеющего препарат, одобренный в результате успешных испытаний фазы III, составили 2,6 миллиарда долларов (в долларах 2013 года), и эта сумма увеличивается ежегодно на 8,5%. В период 2003–2013 гг. Для компаний, которые одобрили 8–13 препаратов, стоимость одного препарата может вырасти до 5,5 млрд долларов, в основном из-за международной географической экспансии маркетинга и текущих затрат на .
Альтернативы разработке традиционных лекарств имеют целью объединить университеты, правительства и фармацевтическую промышленность и оптимизировать ресурсы.
Вычислительные инициативы
Новые инициативы включают партнерство между правительственными организациями и промышленностью, такими как европейские Инициатива по инновационным лекарствам. Соединенные штаты Управление по контролю за продуктами и лекарствами создал «Инициатива критического пути» для повышения инноваций в разработке лекарств, и Прорыв в терапии назначение для ускорения разработки и регулятивного обзора лекарственных препаратов-кандидатов, для которых предварительные клинические данные показывают, что лекарство-кандидат может существенно улучшить терапию серьезного расстройства.
В марте 2020 г. Министерство энергетики США, Национальный фонд науки, НАСА, промышленность и девять университетов объединили ресурсы для доступа к суперкомпьютерам из IBMв сочетании с ресурсами облачных вычислений от Hewlett Packard Enterprise, Amazon, Microsoft, и , за открытие лекарств. Консорциум высокопроизводительных вычислений COVID ‑ 19 также нацелен на прогнозирование распространения заболеваний, моделирование возможных вакцин и скрининг тысяч химических соединений для разработки вакцины или терапии COVID ‑ 19. В мае 2020 года партнерство OpenPandemics — COVID ‑ 19 между Scripps Research и IBM Сетка мирового сообщества был запущен. Партнерство представляет собой проект распределенных вычислений, который «автоматически запустит моделируемый эксперимент в фоновом режиме , который поможет предсказать эффективность конкретного химического соединения в качестве возможного лечения COVID ‑ 19».
Персонализированная информация о здоровье
Приложение Healthcheck от британского поставщика медуслуг Babylon Health записывает данные о состоянии здоровья в цифровых двойниках. Оно работает с данными, введенными вручную: анамнез, трекер настроения пациента, трекер симптомов и автоматический захват данных с его фитнес-устройств и других носимых гаджетов, например, Apple Watch. Цифровой двойник может предоставить врачу оперативную информацию и помочь ему определить приоритеты в терапии.
Цифровые двойники могут также облегчить работу сотрудникам службы поддержки. Графическая база данных американской TigerGraph позволяет интегрировать данные из разных источников для создания полной карты здоровья пациента. Это снижает время обработки вызовов call-центров на 10% и экономит сотни миллионов долларов. Услугами базы пользуется американская UnitedHealth Group, которая насчитывает почти 50 млн участников.
II ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат. Основная цель клинических исследований второй фазы — найти
оптимальный уровень дозировки и подобрать схему приёма препарата для следующей, третьей фазы. Дозы препарата, которые получают пациенты на данном этапе, зачастую ниже, чем самые высокие дозы, которые принимали участники фазы I.
Задачи:
- исследование на пациентах;
- определение отношения доза/эффект;
- определение дозировки/дозировок;
- помочь определиться с дальнейшим дизайном исследований;
- оценка безопасности;
- оценка эффективности;
- принятие решения о целесообразности дальнейших исследований.
Дизайн:
- сравнительные (разные дозы препарата);
- заслепленные/рандомизированные.
Геномная медицина
Исследователи из шведского Линчёпингского университета занимаются сопоставлением РНК больных ревматоидным артритом мышей с цифровым двойником этих цепочек. Они выявляют клетки с активными генами, которые становятся целями препаратов, чтобы найти самые эффективные по действию лекарства и рассчитать их дозы. Цель состоит в том, чтобы персонализировать диагностику и лечение человека с помощью копий его РНК. Исследователи отметили, что обычно лекарства от артрита не действуют примерно в 40–70% случаев.
Подобные методы используют также, чтобы создавать карты характеристик человеческих Т-клеток, которые играют решающую роль в иммунной защите организма. Эти карты могут помочь диагностировать многие распространенные заболевания на ранних стадиях, чтобы сделать их лечение более эффективным и дешевым.
Степень успеха
Теоретически кандидаты на создание нового лекарства для лечения болезни могут включать от 5 000 до 10 000 химических соединений. В среднем около 250 из них достаточно перспективны для дальнейшей оценки с использованием лабораторных тестов, мышей и других подопытных животных. Обычно около десяти из них подходят для испытаний на людях. Исследование, проведенное Центром Тафтса по изучению разработки лекарственных средств, охватывающее 1980-е и 1990-е годы, показало, что только 21,5 процента лекарств, которые начали испытания фазы I, были в конечном итоге одобрены для продажи. За период с 2006 по 2015 год показатель успешности составил 9,6%. Высокая частота неудач, связанная с разработкой фармацевтических препаратов, называется проблемой «скорости истощения»
Чтобы избежать дорогостоящих неудач, важно принимать осторожные решения во время разработки лекарств. Во многих случаях разумная программа и дизайн клинических испытаний могут предотвратить ложноотрицательные результаты
Хорошо спланированные исследования по подбору доз и сравнения как с плацебо, так и с группой лечения золотым стандартом играют важную роль в получении надежных данных.
Регистрация фармацевтических препаратов: подготовительный этап
Подготовка к подаче заявления на регистрацию в Минздрав – серьезный этап, которому нужно уделить максимальное внимание. В роли заявителя имеет право выступать организация, производящая лекарственные средства, либо организация, которая представляет ее интересы – например, в случае, если заявление подает иностранный производитель
В ходе подготовки ей придется выполнить несколько длительных и дорогих процедур, результатом которых станет составление пакета документов для подачи в министерство.
Подготовительные процедуры в ходе подготовки к процессу регистрации лекарственных препаратов разрешается реализовывать параллельно. В список таких операций входят:
- прохождение производителем особой проверки, выполняемой инспекторами Минпромторга. Эта процедура по действующему закону стала обязательным компонентом системы сертификации лекарственных средств с 2016 года. Она выполняется в целях контроля соответствия конкретного производителя требованиям необходимой производственной практики. Ее результатом становится оформление сертификата GMP, который входит в список документов, представляемых на регистрацию;
- клиническое исследование препарата, которое предполагает выполнение испытаний с участием людей. Основной целью таких исследований становится оценка действенности и безопасности средства и выбор правильных дозировок и лекарственных форм для конкретного средства. Для отдельных категорий лекарств, например, дженериков препаратов, зарегистрированных в России более чем 20 лет назад, или медицинских газов, такое исследование не проводится. Если организация КИ не требуется, производитель вправе выполнить исследования в рамках процедуры добровольной сертификации лекарственных средств. Результаты выполненных испытаний оформляются отчетом установленной формы – он тоже входит в состав пакета документов, подаваемых в Минздрав;
- подготовка регистрационного досье. Согласно приказу Минздрава Минздрава от 12 июля 2017 г. N 409н сейчас оно оформляется в виде общетехнического документа (ОТД);
- выбор образцов продукта для представления на экспертизу, предусмотренную правилами сертификации лекарственных средств. Отобранные образцы должны входить в одну производственную серию, что подтверждается сертификатом ее анализа.
Прохождение всех этапов этого алгоритма требуется для любой схемы сертификации лекарственных средств. Невыполнение этого условия может обернуться причиной проблем уже на этапе подачи заявления: в течение десяти дней эксперты Минздрава рассмотрят пакет документов и отправят его на доработку.

